Зомета инфузионный концентрат 4 мг / 5 мл флакон 5 мл
Zometa Infusionskonzentrat 4 mg / 5ml Durchstechflasche 5 ml
-
43739.47 RUB
При оплате криптовалютой:
Ваша прибыль 4373.95 RUB / 50.81 USDT
- Наличие: Нет в наличии
- Производитель: NOVARTIS SCHWEIZ AG
- Модель: 2710243
- ATC-код M05BA08
- EAN 7680562570024
Описание
состав
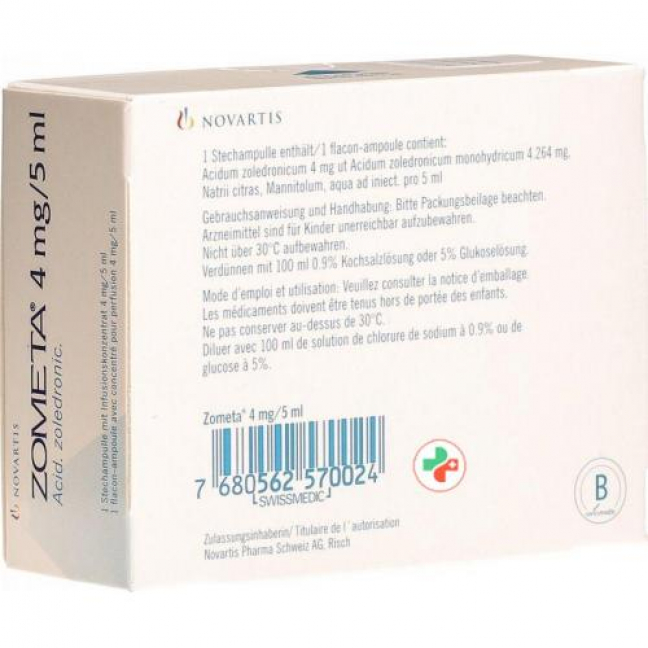
Активное вещество: золедроновая кислота (в виде моногидрата золедроната).
Вспомогательные вещества: натрия цитрат, маннитол, вода для инъекций на 5 мл.
Галеновая форма и количество активного ингредиента на единицу
Флакон концентрата для инфузий, 4 мг безводного золедроновой кислоты (но 4,264 мг моногидрата золедроновой кислоты).
Показания/Возможные области применения
Для лечения больных с костными метастазами солидных опухолей и множественной миеломы в сочетании со стандартной противоопухолевой терапией.
Лечение злокачественной гиперкальциемии (ГКМП), определяемой как кальций с поправкой на альбумин сыворотки (cCa) >12,0 мг/дл [3,0 ммоль/л]
Дозировка/применение
Зомету нельзя смешивать с инфузионными растворами, содержащими кальций или другие двухвалентные катионы (такими как раствор Рингера с лактатом), и следует вводить в виде однократного внутривенного раствора в специальную капельницу отдельно от всех других лекарственных средств в течение не менее 15 минут.
Дозировка у взрослых и пациентов пожилого возраста
Рекомендуемая доза составляет 4 мг золедроновой кислоты. Концентрат Зометы для инфузий (4 мг/5 мл) дополнительно разбавляют 100 мл 0,9% физиологического раствора или 5% раствора глюкозы и вводят в виде внутривенной инфузии. Продолжительность инфузии не должна быть менее 15 минут (см. «Предупреждения и меры предосторожности»).
Перед введением Зометы необходимо проверить жидкостный статус пациента. Потребление жидкости должно соответствовать клиническому состоянию.
Однократную инфузию следует проводить при злокачественной гиперкальциемии (кальций сыворотки с поправкой на альбумин ≥3,0 ммоль/л или 12 мг/дл).
При метастазах в кости и множественной миеломе Зомету следует вводить каждые 3-4 недели. Пациенты также должны получать 500 мг кальция и 400 МЕ витамина D перорально в день.
Дозировка при почечной недостаточности
Лечение препаратом Зомета у пациентов со злокачественной гиперкальциемией (ГКМП) и тяжелой почечной недостаточностью следует рассматривать только после оценки пользы и риска лечения. Из клинических исследований исключались пациенты с уровнем креатинина в сыворотке ≥400 мкмоль/л или ≥4,5 мг/дл. Для пациентов с ГКМП с уровнем креатинина в сыворотке <400 мкмоль/л или <4,5 мг/дл коррекции дозы не требуется.
В начале лечения препаратом Зомета у пациентов с множественной миеломой или с метастазами солидных опухолей в кости следует оценить уровень креатинина в сыворотке крови и клиренс креатинина (КК). CLcr рассчитывается на основе значения креатинина в сыворотке по формуле Кокрофта-Голта. Зомета не рекомендуется назначать пациентам с тяжелой почечной недостаточностью (КК <30 мл/мин) до начала терапии. Из клинических исследований Зометы исключались пациенты с уровнем креатинина в сыворотке >265 мкмоль/л или >3,0 мг/дл.
Пациентам с метастазами в кости и почечной недостаточностью легкой и средней степени тяжести (КК 30–60 мл/мин) до начала лечения рекомендуются следующие дозы Зометы:
Если CLcr <30 мл/мин, лечение препаратом Зомета не рекомендуется (см. «Предупреждения и меры предосторожности»). при CLcr >60 мл/мин — 4,0 мг; при ККр 50-60 мл/мин - 3,5 мг; при CLcr 40–49 мл/мин — 3,3 мг и при CLcr 30–39 мл/мин — 3,0 мг.
Дозы рассчитывали, предполагая, что целевая AUC составляет 0,66 (мг × ч/л) (CLcr=75 мл/мин). Ожидается, что сниженные дозы для пациентов с почечной недостаточностью позволят достичь той же AUC, что и у пациентов с клиренсом креатинина 75 мл/мин.
После начала лечения следует измерять уровень креатинина в сыворотке крови перед приемом каждой дозы Зометы и прекращать лечение при ухудшении функции почек.
В клинических испытаниях почечная недостаточность определялась следующим образом:
Для нормального исходного уровня креатинина сыворотки (<1,4 мг/дл) увеличение ≥0,5 мг/дл, а для аномального исходного уровня креатинина сыворотки (>1,4 мг/дл) увеличение ≥1,0 мг/дл.
Лечение препаратом Зомета не следует возобновлять до тех пор, пока уровень креатинина не превысит исходный уровень более чем на 10 % (см. раздел «Побочное действие»).
Зомету следует возобновить в той же дозе, что и до прекращения лечения.
Дозирование при печеночной недостаточности
Поскольку отсутствуют клинические данные о лечении пациентов с тяжелой печеночной недостаточностью, для этих пациентов нельзя дать конкретных рекомендаций.
педиатрия
Безопасность и эффективность Зометы у детей и подростков не изучались.
противопоказания
Зомета противопоказана при беременности и в период лактации (см. Беременность и лактация), пациентам с повышенной чувствительностью к золедроновой кислоте, другим бисфосфонатам или любому другому компоненту Зометы.
Предупреждения и меры предосторожности
Общие
Все пациенты, в том числе с легкой и умеренной почечной недостаточностью, должны быть адекватно гидратированы перед введением Зометы.
Любая гипокальциемия, гипофосфатемия или гипомагниемия требует эффективного лечения.
Следует избегать гипергидратации у пациентов с риском развития сердечной недостаточности.
После начала терапии препаратом Зомета следует тщательно контролировать сывороточные уровни кальция с поправкой на альбумин (см. Показания к применению), фосфатов и магния, а также уровень креатинина в сыворотке.
После операции на щитовидной железе пациенты могут быть особенно восприимчивы к гипокальциемии в результате относительного гипопаратиреоза.
Пациенты с остеолитическими метастазами в кости или с остеолизом множественной миеломы без гиперкальциемии должны получать адекватные добавки кальция и витамина D.
При возникновении гипокальциемии, гипофосфатемии или гипомагниемии может потребоваться кратковременная заместительная терапия. Пациенты с неконтролируемой гиперкальциемией, как правило, имеют некоторую почечную недостаточность, и следует рассмотреть вопрос о тщательном наблюдении за функцией почек.
Зомета содержит то же активное вещество, что и Акласта ® (золедроновая кислота). Пациенты, получающие Зомету, не должны лечиться одновременно с Акластой.
При принятии решения о лечении больных с метастазами в кости для предотвращения скелетных явлений следует учитывать, что эффект лечения наступает через 2-3 мес.
Почечная недостаточность
У пациентов с ГКМП с признаками почечной недостаточности следует считать, что потенциальная польза от продолжения лечения препаратом Зомета превышает потенциальный риск (см. раздел «Способ применения и дозы»).
Если Зомета вводится менее 15 минут, риск повышения уровня креатинина увеличивается в 2 раза. Таким образом, время инфузии должно составлять не менее 15 минут, и его следует тщательно контролировать. Хотя риск снижается при приеме дозы 4 мг в течение не менее 15 минут, ухудшение функции почек все же может произойти. Сообщалось об ухудшении функции почек, прогрессировании почечной недостаточности и диализе у пациентов после первой дозы или после однократной дозы Зометы.
Факторы, которые могут увеличить вероятность ухудшения функции почек, включают обезвоживание, ранее существовавшую почечную недостаточность, многократные циклы Зометы или других бисфосфонатов, использование нефротоксичных препаратов или использование более коротких инфузий, чем рекомендуется в настоящее время.
Уровни креатинина в сыворотке следует измерять перед приемом каждой дозы Зометы. При лечении пациентов с метастазами в кости и нарушением функции почек легкой и средней степени тяжести в начале лечения рекомендуются более низкие дозы зометы. Лечение Зометой следует возобновить в той же дозе, что и до прерывания лечения. У пациентов с признаками ухудшения функции почек во время лечения Зомету не следует возобновлять до тех пор, пока повышение уровня креатинина не станет менее чем на 10 % выше исходного уровня. (см. «Дозировка/применение»).
Зомета была связана с сообщениями о дисфункции почек. В объединенном анализе данных по безопасности основных исследований Зометы по предотвращению скелетных событий у пациентов с прогрессирующим злокачественным новообразованием костей частота нежелательных явлений почечной дисфункции, предположительно связанных с Зометой, была следующей: множественная миелома (3,2% ), рак предстательной железы (3,1 %), рак молочной железы (4,3 %), легкого и другие солидные опухоли (3,2 %).
Применение Зометы у пациентов с тяжелой почечной недостаточностью не рекомендуется, так как данные о клинической безопасности и фармакокинетике в этой популяции ограничены, а также существует риск ухудшения функции почек у пациентов, получающих бисфосфонаты, включая Зомету. В клинических исследованиях пациентами с тяжелой почечной недостаточностью считались пациенты с исходным уровнем креатинина в сыворотке ≥400 мкмоль/л или ≥4,5 мг/дл. В фармакокинетических исследованиях пациенты с тяжелой почечной недостаточностью определялись как пациенты с исходным клиренсом креатинина <30 мл/мин (см. Фармакокинетика и Способ применения и дозы).
Остеонекроз
Остеонекроз челюсти
О случаях остеонекроза челюсти сообщалось преимущественно у онкологических больных, получавших лечение бисфосфонатами, включая Зомету. Многие из этих пациентов также получали химиотерапию и кортикостероиды или препараты, препятствующие ангиогенезу. У многих были признаки местной инфекции, включая остеомиелит.
Пострегистрационный опыт и литература свидетельствуют о более высокой частоте остеонекроза челюсти в зависимости от типа опухоли (распространенный рак молочной железы, множественная миелома) и состояния зубов (удаление зуба, заболевание десен, местная травма, включая неподходящие зубные протезы).
Онкологические больные должны поддерживать хорошую гигиену полости рта и должны пройти стоматологическое обследование с учетом соответствующей стоматологической профилактики перед началом лечения бисфосфонатами.
По возможности следует избегать инвазивных стоматологических процедур у этих пациентов во время лечения бисфосфонатами. У пациентов, у которых развился остеонекроз челюсти при лечении бисфосфонатами, стоматологическая хирургия может ухудшить состояние. Для пациентов, нуждающихся в стоматологическом лечении, нет данных, позволяющих предположить, что прерывание лечения бисфосфонатами снижает риск остеонекроза челюсти. Клиническое заключение лечащего врача должно определять терапевтический план на основе оценки пользы и риска для каждого отдельного пациента.
Остеонекроз в других частях тела
Сообщалось также о случаях остеонекроза в других частях тела, включая бедро, бедренную кость и наружный слуховой проход, особенно у взрослых больных раком, получавших бисфосфонаты, включая Зомету.
Атипичные переломы бедренной кости
Сообщалось об атипичных подвертельных и диафизарных переломах бедренной кости при терапии бисфосфонатами, в основном у пациентов, длительно лечащихся от остеопороза. Эти поперечные переломы или короткие косые переломы могут возникать в любом месте бедренной кости от чуть ниже малого вертела до мыщелков. Эти переломы возникают после минимальной травмы или без нее, и некоторые пациенты испытывают боль в бедре или паху, часто связанную с рентгенологическими признаками стрессового перелома, за несколько недель или месяцев до развития полного перелома бедренной кости. Переломы часто двусторонние; поэтому у пациентов, получающих бисфосфонаты, с переломом диафиза бедренной кости, также следует осмотреть контралатеральную бедренную кость. Сообщалось также о плохом заживлении этих переломов. Следует рассмотреть вопрос о прекращении терапии бисфосфонатами у пациентов с подозрением на атипичный перелом бедренной кости до оценки состояния пациента на основе индивидуальной оценки пользы и риска. Сообщалось об атипичных переломах бедренной кости у больных раком, получавших Зомету.
Пациентов следует проинструктировать о необходимости сообщать о любых болях в бедре, колене или паху во время терапии препаратом Зомета; Пациентов с такими симптомами следует обследовать на наличие неполного перелома бедренной кости.
Гипокальциемия
Сообщалось о случаях гипокальциемии у пациентов, получавших Зомету. Сообщалось о сердечной аритмии и неврологических побочных эффектах (судороги, тетания и онемение) в случаях тяжелой гипокальциемии. В некоторых случаях гипокальциемия может быть опасной для жизни. Следует соблюдать осторожность при одновременном применении Зометы с другими лекарственными средствами, вызывающими гипокальциемию, поскольку они могут действовать синергически и приводить к тяжелой гипокальциемии (см. Взаимодействие). Перед началом лечения препаратом Зомета следует измерить уровень кальция в сыворотке крови и скорректировать гипокальциемию. Пациенты должны получать адекватное количество кальция и витамина D.
Скелетно-мышечная боль
При применении бисфосфонатов (включая золедронат) в ходе рыночного надзора сообщалось о случаях сильной, а иногда и изнурительной боли в костях, суставах и/или мышцах. В одних случаях эта боль возникала в течение первых суток, в других — через несколько месяцев после начала терапии. В большинстве случаев боль была обратимой после отмены препарата. У некоторых пациентов наблюдался рецидив симптомов при повторном применении того же или другого бисфосфоната.
Фертильность
Фертильность снижалась у крыс при подкожном введении золедроновой кислоты в дозе 0,1 мг/кг/сут. На людях данных нет.
Взаимодействия
Рекомендуется соблюдать осторожность при одновременном назначении бисфосфонатов с аминогликозидами, кальцитонином или петлевыми диуретиками, поскольку эти классы препаратов могут проявлять аддитивный гипокальций-снижающий эффект, что может привести к снижению уровня кальция в сыворотке на более длительный период, чем требуется (см. «Особые указания и меры предосторожности»).
Следует соблюдать осторожность при назначении Зометы с другими препаратами, которые также могут влиять на функцию почек (см. Побочные эффекты).
Следует соблюдать осторожность при одновременном применении Зометы с ингибиторами ангиогенеза, поскольку у пациентов, получавших одновременно эти лекарственные средства, наблюдалась повышенная частота некроза челюсти.
Беременность / Грудное вскармливание
женщины детородного возраста
Существует возможный риск повреждения плода (например, скелетные и другие аномалии), если женщина забеременеет во время лечения бисфосфонатом (см. Противопоказания). Женщины детородного возраста должны использовать эффективные методы контрацепции во время лечения Зометой, если лечение неизбежно или его нельзя откладывать. Золедронат включается в костный матрикс и постепенно высвобождается после завершения лечения, что может занять от нескольких недель до нескольких лет. Количество, которое может быть высвобождено, зависит от общей введенной дозы. Системное воздействие из-за этого выброса неизвестно, и связанный с этим риск в случае беременности не может быть оценен.
беременность
Исследования на крысах показали репродуктивную токсичность (см. Доклинические данные). Потенциальный риск для человека неизвестен.
Зомету нельзя применять во время беременности (см. Противопоказания).
лактация
Опыта кормления грудью нет. Поэтому Зомету здесь применять не следует (см. «Противопоказания»).
Влияние на способность управлять автомобилем и работать с механизмами
Опыт воздействия на способность управлять транспортными средствами и механизмами отсутствует.
Нежелательные эффекты
Наиболее серьезными побочными реакциями, зарегистрированными у пациентов, получавших Зомету по утвержденным показаниям, являются: анафилактическая реакция, побочные реакции со стороны глаз, остеонекроз челюсти, атипичный перелом бедренной кости, мерцательная аритмия, нарушение функции почек, острофазовая реакция и гипокальциемия.
Побочные эффекты Зометы аналогичны тем, о которых сообщалось для других бисфосфонатов, и их можно ожидать примерно у одной трети пациентов. Наиболее распространенными являются гриппоподобные симптомы, включая боль в костях (9,1%), лихорадку (7,2%), утомляемость (4,1%), озноб (2,9%), артралгию и миалгию (около 3%) и артрит с сопутствующим отеком суставов. Эти нежелательные эффекты обычно исчезают в течение нескольких дней.
Острая фаза реакции сопровождается различными симптомами, такими как гриппоподобные симптомы, утомляемость, лихорадка, озноб и боль в костях. Как правило, эти симптомы появляются в течение 3 дней после инфузии золедроната и обычно исчезают в течение нескольких дней. Симптомы также известны как «гриппоподобные» или «последозовые» симптомы.
Снижение экскреции кальция с мочой очень часто сопровождается бессимптомным снижением уровня фосфатов в сыворотке, не требующим лечения. Уровни кальция в сыворотке часто могут падать до бессимптомного гипокальциемического уровня.
Нежелательные эффекты перечислены в соответствии с их частотой.
Наиболее распространенный побочный эффект указан первым. Используется следующее описание:
«Очень часто» (≥1/10), «часто» (≥1/100 до <1/10), «нечасто» (≥1/1000 до <1/100), «редко» (≥1/10' 000, <1/1000), «очень редко» (<1/10000), включая единичные случаи.
Кровь и лимфатическая система
Часто: анемия.
Нечасто: тромбоцитопения, лейкопения.
Редко: панцитопения.
Иммунная система
Нечасто: реакции гиперчувствительности, крапивница, анафилактическая реакция/шок.
Редко: ангионевротический отек.
Метаболизм и питание
Очень часто: гипофосфатемия.
Часто: гипокальциемия.
Нечасто: гипомагниемия, гипокалиемия.
Редко: гиперкалиемия, гипернатриемия.
Психические расстройства
Часто: нарушения сна.
Нечасто: беспокойство, тревога.
Редко: состояние спутанности сознания.
Нервная система
Часто: головная боль, парестезия.
Нечасто: головокружение, дисгевзия, гипестезия, гиперестезия, тремор, сонливость.
Очень редко: судороги, гипестезия и тетания (как следствие гипокальциемии).
Глаза
Часто: конъюнктивит.
Нечасто: нечеткость зрения, склерит, воспаление орбиты.
Редко: увеит.
Очень редко: эписклерит.
Дисфункции сердца
Нечасто: мерцательная аритмия.
Редко: брадикардия, сердечные аритмии (вследствие гипокальциемии).
сосудистая дисфункция
Часто: артериальная гипертензия.
Нечасто: артериальная гипотензия, ортостатическая гипотензия вплоть до обморока/сосудистого коллапса.
Органы дыхания
Нечасто: одышка, кашель.
Редко: интерстициальное заболевание легких.
Очень редко : бронхоспазм.
Желудочно-кишечные расстройства
Часто: тошнота, рвота, снижение аппетита, запор.
Нечасто: диарея, боль в животе, диспепсия, стоматит, сухость во рту.
Кожа
Часто: повышенное потоотделение.
Нечасто: зуд, сыпь (в том числе эритематозная и пятнистая).
Костно-мышечной системы
Часто: боль в костях, миалгия, артралгия, тугоподвижность суставов.
Нечасто: мышечные спазмы, остеонекроз челюсти (см. раздел 4.4).
Редко : атипичные подвертельные и диафизарные переломы бедренной кости, артрит и припухлость суставов как симптом острой фазы реакции.
Очень редко: остеонекроз в других частях тела.
почки и мочевыводящие пути
Часто: нарушение функции почек, повышение уровня креатинина и мочевины в сыворотке.
Нечасто: острая почечная недостаточность, гематурия, протеинурия.
Редко: приобретенный синдром Фанкони.
Общие расстройства и реакции в месте применения
Часто: генерализованная боль в теле, реакция острой фазы, лихорадка, гриппоподобные симптомы (включая утомляемость, озноб, недомогание, приливы), периферические отеки, астения.
Нечасто: реакции в месте введения (включая боль, раздражение, отек, уплотнение, покраснение), боль в груди, увеличение массы тела.
Передозировка
Клинический опыт острой передозировки Зометой ограничен. Пациенты, получающие более высокие, чем рекомендуемые дозы, должны находиться под тщательным наблюдением, поскольку наблюдались нарушения функции почек (включая почечную недостаточность) и нарушения электролитного баланса сыворотки (включая кальций, фосфор и магний). В случае гипокальциемии инфузии глюконата кальция следует проводить по клиническим показаниям.
Свойства/Эффекты
Код УВД: M05BA08
Механизм действия/фармакодинамика
Золедроновая кислота представляет собой бисфосфонат, который действует преимущественно на кости. Золедроновая кислота является ингибитором резорбции кости, вызванной повышенной активностью остеокластов.
Избирательное действие бисфосфонатов на костную ткань обусловлено их высоким сродством к минерализованной кости.
Молекулярный механизм действия еще не известен. В долгосрочных исследованиях на животных золедроновая кислота ингибировала резорбцию кости, не оказывая неблагоприятного влияния на формирование кости, минерализацию или механические свойства.
Клиническая эффективность при солидных опухолях и множественной миеломе
Костные метастазы
В двойном слепом рандомизированном исследовании III фазы зомета 4 мг сравнивалась с памидронатом 90 мг. 1122 пациента с множественной миеломой или раком молочной железы и по крайней мере с одним поражением костей получали лечение зометой 4 мг (564 пациента) или памидронатом 90 мг (558 пациентов) каждые 3-4 недели.
Первичной конечной точкой была доля пациентов, по крайней мере, с одним SRE (= событие, связанное со скелетом) (вертебральные, невертебральные переломы, компрессия спинного мозга, лучевая терапия костей, операции на костях). Число пациентов с SRE составило 44% для зометы и 46% для памидроната (95% ДИ -7,9%, 3,7%).
606 пациентов лечились еще 12 месяцев.
Результаты глобального анализа основных данных, а также дополнительных данных показали, по крайней мере, сравнимую эффективность предотвращения SRE при применении Зометы в дозе 4 мг и памидроната в дозе 90 мг: количество SRE составило 48% для Зометы и 52% для памидронат (95% доверительный интервал -9,3%, 2,5%). Анализ возникновения множественных событий показал дополнительное снижение риска на 16% в группе зометы по сравнению с группой памидроната (р=0,03).
В 15-месячном исследовании рака предстательной железы (214 мужчин получали Зомету в дозе 4 мг и 208 мужчин получали плацебо) было показано, что Зомета имеет значительное преимущество перед плацебо как по числу пациентов, перенесших по крайней мере один SRE (33% для Зометы, так и по сравнению с плацебо). 4 мг против 44% для плацебо; p=0,021), а также среднее время до первого возникновения SRE (отношение рисков 0,672 [0,492, 0,918] p=0,012).
186 пациентов лечились еще 9 месяцев. SRE для Зометы 38%, для плацебо 49% (р=0,028). Среднее время до первого возникновения SRE также было замедлено при приеме Зометы 4 мг (488 дней для Зометы 4 мг против 321 дня для плацебо; р=0,009). Зомета также снижала ежегодное число SRE (уровень заболеваемости скелета) на одного пациента (0,77 для Зометы по сравнению с 1,47 для плацебо; p = 0,005). Анализ возникновения множественных событий показал снижение риска возникновения SRE на 36% в группе Zometa по сравнению с плацебо (p = 0,002). Измерения боли проводились на исходном уровне и периодически на протяжении всего исследования. Пациенты, принимавшие Зомету, сообщали о меньшем усилении боли, чем пациенты, принимавшие плацебо. Эта разница была достоверной через 3, 9, 21 и 24 месяца. У меньшего числа пациентов с Зометой были патологические переломы. Эффекты лечения были менее выражены у пациентов с бластными поражениями.
В одном исследовании сравнивали 407 пациентов с другими солидными опухолями с метастазами в костях, принимавших Зомету, и плацебо в течение 9 месяцев. 101 пациент был включен в расширение, 26 лечились в общей сложности 21 месяц. Отмечался значительно более длительный временной интервал до первого SRE через 9 месяцев (p=0,03), но не было существенной разницы в количестве пациентов с SRE по сравнению с плацебо. Через 9 месяцев у 38% пациентов, принимавших Зомету, был хотя бы один SRE (+ГКМП) по сравнению с 44% пациентов в группе плацебо (p=0,127) и у 39% против 48% (p=0,039) в конце исследования. расширения.
Медиана времени до первого возникновения SRE составила 236 дней для Зометы по сравнению с 155 днями для плацебо (p = 0,009), а годовое количество SRE на одного пациента (коэффициент заболеваемости скелета) составило 1,74 для Зометы по сравнению с 2,71 для плацебо (p = 0,009). 0,012) . Анализ возникновения множественных событий показал снижение риска SRE на 30,7% в группе Zometa по сравнению с плацебо (p = 0,003). Эффект лечения у больных НМРЛ оказался меньше, чем у больных с другими солидными опухолями.
Хотя в упомянутых выше исследованиях не было зарегистрировано значительного влияния на боль в костях, это было показано в исследовании, проведенном в Японии с участием 228 женщин с раком молочной железы и метастазами в костях. Это двойное слепое плацебо-контролируемое исследование, в котором в течение 48 недель применяли Зомету в дозе 4 мг или плацебо. Соотношение осложнений со стороны скелета для Зометы и плацебо составило 0,61 (р=0,027). У пациентов, получавших Зомету, уменьшение боли в костях наблюдалось по Краткой шкале боли (BPI) через 4 недели после начала лечения.
Гиперкальциемия
Сравнительные исследования с памидронатом показали, что золедроновая кислота снижает экскрецию кальция в сыворотке и с мочой при опухолевой гиперкальциемии.
Частота полного ответа через 10 дней составляет 88,4% для зометы и 69,7% для памидроната. Разница между Зометой и памидронатом была статистически значимой.
В половине случаев однократное вливание Зометы может снизить повышенный уровень кальция в сыворотке крови до нормы в течение 4 дней. Среднее время до рецидива гиперкальциемии составляло от 30 до 40 дней для Зометы по сравнению с 20-22 днями для памидроната.
Частота ответа (полный ответ) около 52% была обнаружена при повторном лечении в случае восстановления скорректированного уровня кальция в сыворотке >2,9 ммоль/л.
Фармакокинетика
Поглощение
После начала инфузии золедроновой кислоты концентрация активного вещества в плазме крови быстро увеличивается, достигая максимальной концентрации в плазме крови к концу времени инфузии. Затем следует быстрое снижение до <10% пиковых концентраций в плазме через 4 часа и <1% через 24 часа, после чего следует длительный период очень низких концентраций, не превышающих 0,1% пиковых концентраций в плазме, перед второй инфузией препарата. на 28 день активное вещество занимает место.
Распределение
В течение первых 24 часов 39±16% введенной дозы выводится с мочой. Остальная часть связана с костной тканью.
Золедроновая кислота проявляет низкое сродство к клеткам крови человека, при этом среднее отношение концентрации в крови/плазме составляет 0,59 в диапазоне концентраций от 30 нг/мл до 5000 нг/мл. Связывание с белками плазмы низкое, несвязанная фракция колеблется от 60% при 2 нг/мл до 77% при 2000 нг/мл золедроновой кислоты.
Увеличение времени инфузии с 5 до 15 мин приводит к снижению концентрации золедроновой кислоты на 30% в конце инфузии, но не влияет на AUC.
Как и в случае с другими бисфосфонатами, вариабельность фармакокинетических параметров золедроновой кислоты у разных пациентов высока.
Метаболизм
Золедроновая кислота не ингибирует ферменты Р450 человека in vitro и не метаболизируется. Золедроновая кислота выводится почками в неизмененном виде. Из костной ткани золедроновая кислота очень медленно высвобождается обратно в системный кровоток и выводится почками с периодом полувыведения (t ½ γ) не менее 146 часов. Общий клиренс составляет 5,04±2,5 л/ч независимо от дозы.
Устранение
Выведение золедроновой кислоты, введенной внутривенно, протекает в две фазы: быстрая двухфазная элиминация из системного кровотока с периодом полувыведения 0,24 ч (t ½ α) и 1,8 ч (t ½ β), за которой следует пролонгированная фаза выведения. Даже после многократного приема (каждые 28 дней) не происходит накопления действующего вещества в плазме.
В исследованиях на животных <3% введенной дозы выводилось с фекалиями.
линейность/нелинейность
Фармакокинетика золедроновой кислоты не зависит от дозы.
Кинетика особых групп пациентов
Пациенты с гиперкальциемией. Данные о фармакокинетике золедроновой кислоты у пациентов с гиперкальциемией отсутствуют.
Пациенты с печеночной недостаточностью. Данные о фармакокинетике золедроновой кислоты у пациентов с печеночной недостаточностью отсутствуют. Золедроновая кислота не ингибирует ферменты Р450 человека in vitro и не метаболизируется. В исследованиях на животных <3% введенной дозы выводилось с фекалиями. Это указывает на то, что функция печени не играет существенной роли в фармакокинетике золедроновой кислоты.
Пациенты с почечной недостаточностью . Почечный клиренс золедроновой кислоты коррелирует с клиренсом креатинина. Почечный клиренс соответствует 75±33% клиренса креатинина, который в среднем составил 84±29 мл/мин (от 22 до 143 мл/мин) у 64 обследованных опухолевых больных. Популяционный анализ показал, что у пациентов с клиренсом креатинина 20 мл/мин (тяжелая почечная недостаточность) и 50 мл/мин (умеренная почечная недостаточность) прогнозируемый клиренс золедроновой кислоты составлял 37% и 72% соответственно от клиренса золедроновой кислоты. пациент с клиренсом креатинина 84 мл/мин.
Применение Зометы не рекомендуется пациентам с тяжелой почечной недостаточностью (см. раздел «Побочное действие»).
Влияние пола, возраста и расы
Три фармакокинетических исследования, проведенных у онкологических больных с метастазами в кости, не выявили влияния пола, расы, возраста (от 38 до 84 лет) и массы тела на общий клиренс золедроновой кислоты.
Доклинические данные
Токсикологические исследования
В болюсных исследованиях золедроновую кислоту вводили подкожно крысам и внутривенно собакам в дозах до 0,02 мг/кг/сут в течение 4 недель, и она хорошо переносилась. Введение 0,001 мг/кг/день подкожно крысам и 0,005 мг/кг внутривенно один раз каждые 2-3 дня собакам в течение до 52 недель также хорошо переносилось. Исследования почечной токсичности проводились на крысах и собаках. Внутривенные инфузии до 0,6 мг/кг у крыс и до 0,25 мг/кг у собак хорошо переносились при различных интервалах дозирования.
Наиболее частым обнаружением в исследованиях повторных доз почти для всех доз было увеличение первичного спонгиоза в метафизах длинных костей у растущих животных, что отражает фармакологическую антирезорбтивную активность соединения.
При парентеральном введении золедроновой кислоты почки были идентифицированы как первичный орган-мишень для токсичности.
Репродуктивная токсикология
В исследовании фертильности и эмбрионального развития у крыс фертильность снижалась при подкожном введении золедроновой кислоты в дозе 0,1 мг/кг/сут. При дозе 0,03 мг/кг/день наблюдались потери до и после имплантации. При дозе 0,01 мг/кг/день возникали дистоция, трудности родов и перинатальная материнская смертность. Жизнеспособность и масса тела снижались у потомства при дозе 0,1 мг/кг/день.
Исследования тератогенности проводились на двух видах животных при подкожном введении золедроновой кислоты. Тератогенность наблюдалась у крыс при матернотоксических дозах ≥0,2 мг/кг/сут и проявлялась внешними, висцеральными и скелетными пороками развития. Изменения скелета происходили даже при самой низкой дозе 0,1 мг/кг/день.
У кроликов материнскотоксические эффекты, такие как аборт и смертность, наблюдались при дозе 0,1 мг/кг/день, что, возможно, было связано с гипокальциемией, вызванной лекарственными препаратами. У кроликов не наблюдалось тератогенного или фетотоксического действия, хотя количество поддающихся оценке плодов было низким из-за упомянутой выше материнской токсичности.
Мутагенность
В проведенных тестах на мутагенность золедроновая кислота не показала мутагенных свойств in vitro и in vivo .
Канцерогенность
В исследованиях канцерогенности на грызунах не было выявлено канцерогенного потенциала.
Однако золедроновую кислоту вводили перорально, не зная о системном воздействии на животных.
Другие примечания
Несовместимости
Исследования со стеклянными флаконами, а также с различными инфузионными пакетами и трубками из поливинилхлорида, полиэтилена и полипропилена (предварительно заполненными 0,9% физиологическим раствором или 5% раствором глюкозы) не выявили несовместимости с Зометой.
Во избежание возможной несовместимости концентрат Зометы для инфузий следует разбавлять только 0,9% физиологическим раствором или 5% раствором глюкозы.
Зомету нельзя смешивать с инфузионными растворами, содержащими кальций или другие двухвалентные катионы (такими как раствор Рингера с лактатом), и ее следует вводить в виде однократного внутривенного раствора в отдельную линию от всех других лекарственных средств.
Долговечность
Лекарственный препарат можно использовать только до даты, отмеченной «EXP» на упаковке.
Срок годности разведенного раствора
По микробиологическим причинам готовый к применению препарат следует использовать сразу после разведения.
Особые указания по хранению
Препарат не следует хранить при температуре выше 30 °С.
Инструкции по обращению
Зомета 4 мг/5 мл концентрат для инфузий предназначен только для внутривенного введения. Флакон объемом 5 мл или количество инфузионного концентрата, набранное в соответствии с указанной дозировкой, следует развести 100 мл инфузионного раствора, не содержащего кальция (0,9% физиологический раствор или 5% раствор глюкозы) (см. раздел «Способ применения и дозы»). Заявление").
Уведомление о детях
Лекарства следует хранить в недоступном для детей месте.
Инструкция по приготовлению уменьшенных доз Зометы
Наберите соответствующий объем концентрата (4 мг/5 мл) следующим образом:
- 4,4 мл для дозы 3,5 мг
- 4,1 мл для дозы 3,3 мг
- 3,8 мл для дозы 3,0 мг
Набранный объем концентрата необходимо дополнительно разбавить 100 мл 0,9 % раствора натрия хлорида или 5 % раствора глюкозы. Дозу следует вводить в виде однократной внутривенной инфузии продолжительностью не менее 15 минут.
регистрационный номер
56257 (Швейцария).
Владелец регистрационного удостоверения
Novartis Pharma Schweiz AG, Риш; 6343 Роткройц.
Отзывов (0)
Похожие товары
Вы смотрели

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.